黑色素细胞在形态上较为显著,但在组织学中并不明显。它们负责皮肤和头发的色素形成,因此影响皮肤的外观,并为皮肤提供紫外线 (UVR) 防护。不同物种中的色素突变为研究遗传和发育机制提供了重要信息,也为理解光保护、癌症易感性以及人类进化提供了关键线索。皮肤是人类癌症最常见的发生部位。深入研究黑色素细胞在皮肤生物学中的作用,可能为皮肤病的预防和治疗带来新的机遇。
黑色素细胞能吸收紫外线,并在面对显著的基因损伤压力时存活。皮肤作为人体与外界环境的主要屏障,依靠黑色素细胞产生黑色素来提供光保护和体温调节等功能。色素生成的程度反映为皮肤的“光型”(肤色及晒黑难度),这是预测人群中皮肤癌风险的最有力指标之一。
在羽毛、皮毛和皮肤中的颜色,主要由黑色素细胞决定。除了类胡萝卜素和血红蛋白,黑色素是决定色素的主要因素。黑色素主要有两种类型:红/黄色的红色素和棕/黑色的黑色素。含有黑色素的颗粒被称为黑素体,这些黑素体从黑色素细胞转移至相邻的角质形成细胞,皮肤中大部分色素都在此处存在。因此,色素沉着的差异通常是由黑素体的数量、大小、成分和分布的变化引起的,而黑色素细胞的数量一般保持相对稳定。
影响色素沉着的突变在许多物种中都非常显眼,因此容易被识别。这些突变可以归为四类:低色素沉着和高色素沉着,并且可能伴随或不伴随黑色素细胞数量的变化。根据这些表型差异,科学家能够对与黑色素细胞生长、存活或分化相关的基因进行分类。其中一些突变不是由细胞本身决定的,而是通过细胞间的相互作用发挥作用,揭示了这些细胞间通讯对生理功能的重要性。总体来看,色素沉着或毛色突变成为研究黑色素细胞分化的宝贵资源,也为神经嵴发育和哺乳动物遗传学提供了重要的模型。
在毛囊中,存在两类黑色素细胞群体:黑色素干细胞和其分化后的子代。这两类细胞分布在不同的位置,形成了与周围角质形成细胞紧密相关的毛囊单元。毛囊中的黑色素干细胞不仅在毛发的正常色素沉着中发挥作用,还与年老导致的白发有关。特定的基因缺陷进一步揭示了这些干细胞群体的生存特性。
本综述总结了色素沉着的分子调控机制,并探讨了晒黑反应如何通过增加保护来减少损伤和降低皮肤癌的风险。我们将讨论近年来在相关基因研究方面的进展,以及这些基因如何影响皮肤和毛发的颜色。同时,我们也将介绍黑色素细胞的发育起源,以及这些细胞如何通过黑素母细胞干细胞维持——这些干细胞的耗竭可能是白发产生的原因之一。最后,我们将提出一些未来黑色素细胞生物学研究希望解决的问题。
色素沉着的调控
Regulation of pigmentation
黑皮质素1型受体:
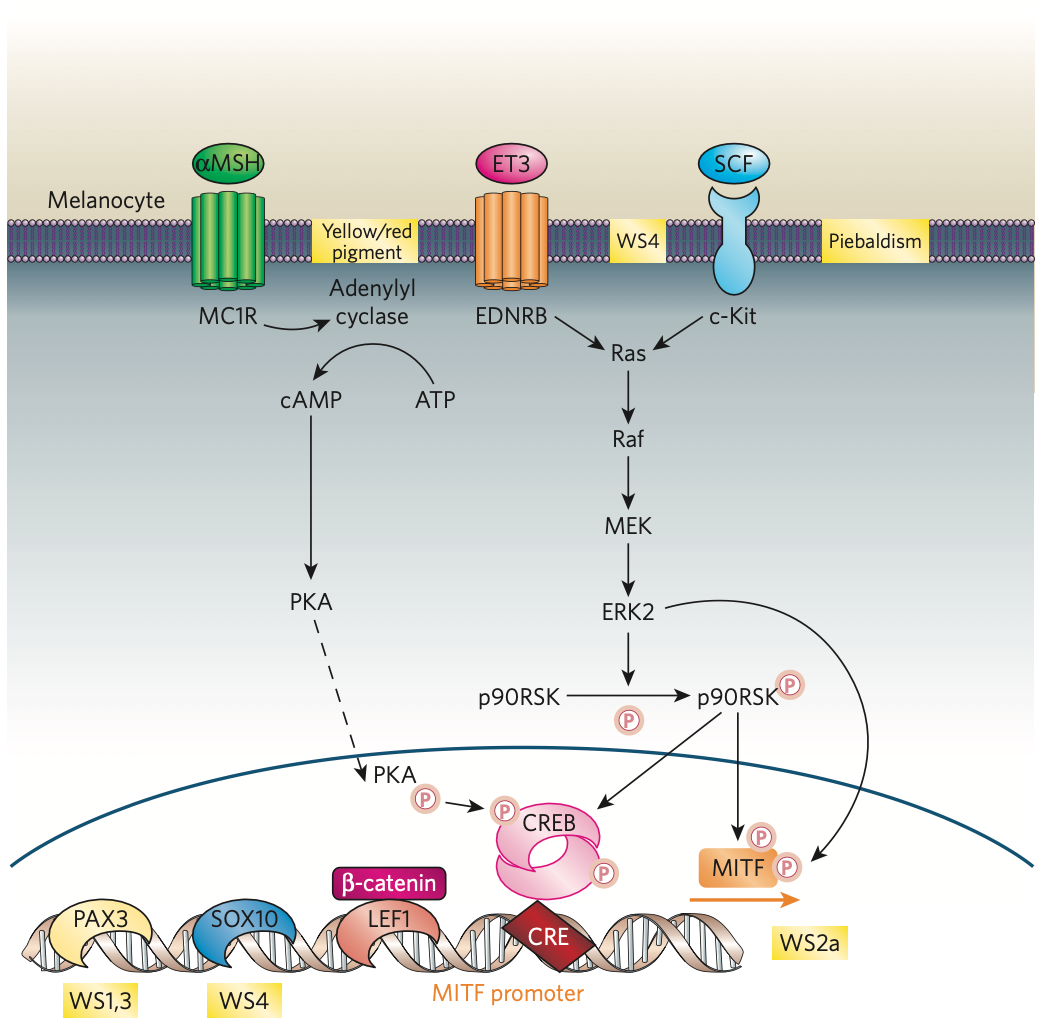
黑色素细胞在许多物种中的色素沉着功能都得以保留。在一些物种(如鱼类)中,色素由其他类型的细胞提供,例如黄素细胞和虹色素细胞。尽管已经鉴定出了100多个参与脊椎动物色素沉着的基因位点,黑皮质素1型受体(MC1R)仍是一个典型的代表,也是决定色素表型的主要因素。延长位点首次在小鼠中发现,并且与毛色的变化有关。隐性突变小鼠拥有黄色或红黄色的毛发,而野生型小鼠的毛发为黑色或棕色。这种突变保留在从猛犸象到现今的猫狗等多种哺乳动物中。此外,黑皮质素家族的其他受体也出现在不同的细胞群体中。例如,MC4R在下丘脑中表达,负责调节能量代谢。
MC1R基因编码一种七跨膜结构的G蛋白偶联受体。当激动剂与MC1R结合时,它会激活腺苷酸环化酶,从而促进环磷酸腺苷(cAMP)的生成。这一过程会进一步引发cAMP反应元件结合蛋白(CREB)转录因子的磷酸化。CREB随后会启动一系列基因的表达,其中包括微小眼转录因子(MITF),该因子是调控多种色素酶和分化因子的关键。人类MC1R的激动剂包括α-黑色素细胞刺激素(α-MSH)和促肾上腺皮质激素(ACTH),这些激动剂通过提高cAMP水平,促进黑色素生成。而Agouti(Asip)基因则编码MC1R的拮抗剂,负责野生型小鼠毛发中的红黄色图案。如果该基因发生了失活突变(称为非Agouti),则会导致小鼠毛发呈现黑色。最近有研究发现,人类Agouti蛋白的非翻译区单核苷酸多态性与深色头发和棕色眼睛之间存在一定关联。
MC1R在头发色素沉着中的作用非常突出。人类MC1R基因区有着高度的多态性,至少有30种等位基因变异,大多数都导致了单个氨基酸的替换。某些替换(如R151C、R160W和D294H)与红发特征相关。红发的表型不仅表现为红色头发,还包括浅色皮肤、晒不黑以及容易长雀斑。功能研究表明,这些变异导致的突变体功能减弱,无法正常结合配体或激活腺苷酸环化酶。因此,如果个体携带两个不同的变异等位基因,可能会产生叠加效应。在小鼠中,第二跨膜区的两个点突变导致了持续活性受体,使得这些小鼠呈现深色毛发的显性表型,不过目前尚未在人体中发现类似的功能增强突变。
通过追踪MC1R基因在不同肤色人群中的分布,提出了多种关于人类色素沉着进化的理论。流行病学研究表明,非洲人群的色素沉着受一定的选择压力影响,而这种压力在离开非洲的族群中逐渐消失。目前尚不清楚这种选择是为了应对紫外线(UVR)诱导的维生素D生成,还是为了保护皮肤免受紫外线引起的DNA损伤,或者是由某个尚未发现的关键途径所驱动。此外,MC1R可能在进化中还有其他生物学意义,例如最近发现MC1R变异等位基因与小鼠和人类中κ-阿片类镇痛效果的增加有关。尽管MC1R在头发和皮肤色素沉着中具有显著影响,但控制皮肤色素沉着的因素并不仅限于MC1R,因为许多浅肤色但深发色的人群并不完全由MC1R决定。
最近,科学家发现了SLC24A5基因,它与斑马鱼的“金色”表型基因同源。尽管该基因的功能尚不完全清楚,但可能通过调节阳离子化学影响黑素小体的成熟过程。人类拥有两种主要的SLC24A5等位基因,仅因单个氨基酸的替换而有所不同。在几乎所有非洲人和亚洲人中,这个替换位点是丙氨酸,而在98%的欧洲人中则是苏氨酸。尽管SLC24A5在人类色素沉着中的具体作用仍需进一步研究,但其变异与人类种群的明显关联表明,它在调控皮肤色素沉着中起着重要作用。
黑素体与黑色素生成:
黑色素的生成主要在一种类似溶酶体的结构——黑素体中进行。红黄色素和真黑色素不仅在颜色上有差异,颗粒的大小、形状和包装方式也不同。这两种黑色素都来自相同的酪氨酸酶依赖途径,且都以酪氨酸为前体。同时也可以衍生出左旋多巴L-DOPA。如果酪氨酸酶或其他重要的色素酶(如P基因,即小鼠粉眼稀释位点的人类同源基因,酪氨酸酶相关蛋白TRP1,和膜相关转运蛋白MATP)缺失或严重失常,则会导致眼皮肤白化症OCA1-4,表现为黑色素细胞功能正常,但无法产生色素。
从多巴醌开始,真黑色素和红黄色素的生成路径分化。真黑色素生成所需的两个关键酶是酪氨酸酶相关蛋白TRP1(也称为GP75或b基因位点)和TRP2(也称为多巴色素异构酶DCT)。TRP1和TRP2与酪氨酸酶具有40-45%的同源性,且是黑色素细胞分化的重要标志。红黄色素由含巯基的半胱氨酸或谷胱甘肽结合形成。因此,红黄色素更容易受光分解,并可产生过氧化氢、超氧化物和羟基自由基等副产物,这些副产物会触发氧化应激,可能进一步引发DNA损伤。单个黑色素细胞通常会合成真黑色素和红黄色素,二者的比例取决于多种因素,包括色素酶的表达情况以及细胞中酪氨酸和含巯基还原剂的可用性。
黑色素通过黑素体传递给角质形成细胞。黑素体的生成、成熟和运输是色素沉着过程中的关键环节,如果此过程发生缺陷,会导致如Hermansky-Pudlak综合征(HPS)和Chediak-Higashi综合征(CHS)等色素减少或色素稀释疾病。在角质形成细胞中,蛋白酶激活受体PAR2是一种七跨膜受体,在黑素体的转移过程中起到核心作用。一旦黑素体进入角质形成细胞,便会被分布开,并在紫外线辐射的刺激下,有策略地在细胞核“向阳面”上形成类似伞状的保护结构。
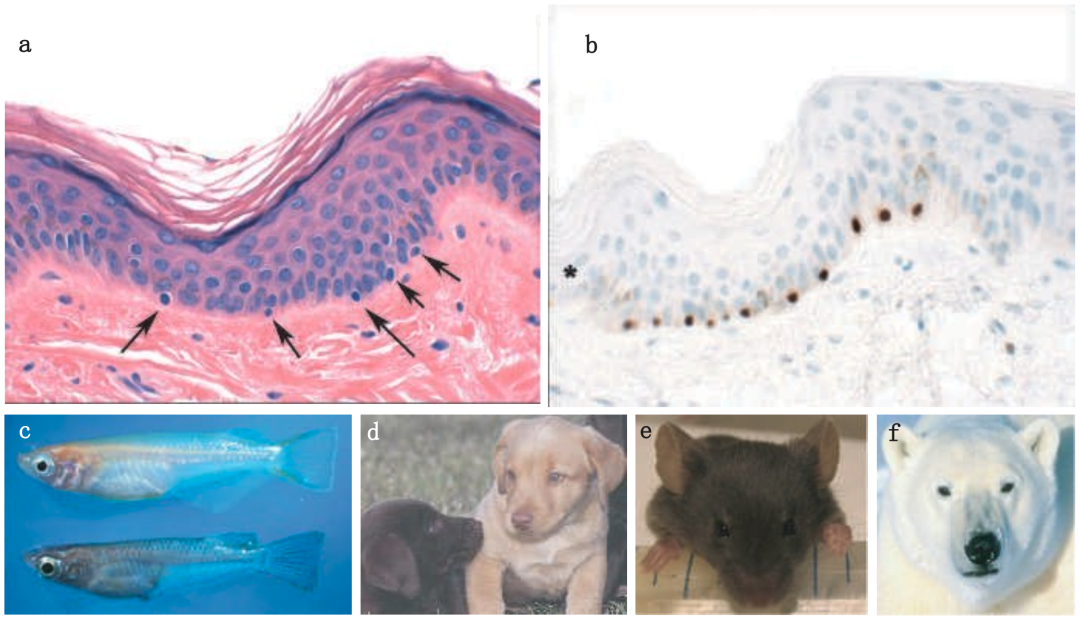
图片来源:文献
黑素细胞和生理反应
Melanocytes and physiological responses
紫外线引起的色素沉着:
获得性色素沉着的最常见例子是晒黑。用肉眼观察,紫外线的作用通常表现为“晒伤”或“晒黑”。日光敏感性是指皮肤因暴露于紫外线后所出现的炎症(如红斑)和色素沉着的程度,这可以通过多种临床表现形式显现。即使是在低剂量的紫外线照射下,DNA损伤也可能发生,甚至在皮肤表面10.2未见明显变化时便已开始。
晒黑反应是人类对环境适应最显著的例子之一。研究表明,α-黑素细胞刺激素(α-MSH)能增加人类的皮肤变黑,这在肾上腺功能不全的患者中尤为明显,因为他们的垂体会分泌过量的激素来进行代偿。促黑素原POMC是α-MSH和促肾上腺皮质激素ACTH的前体,同时也是其他生物活性肽(如β-内啡肽)的前体。尽管最初在垂体中发现,现已证实POMC在皮肤和毛囊中也会产生。POMC在生成后,α-MSH由角质形成细胞和黑色素细胞分泌。在人类中,POMC的突变不仅会导致红发表型(类似于MC1R基因的变异),还会伴随代谢异常如肾上腺功能不全和肥胖。
有证据表明,DNA损伤在触发色素生成中起着至关重要的作用。紫外线,尤其是UVB(波长290–320nm),可导致DNA中的胸苷产生断裂,其典型特征是环丁烷二聚体的形成。使用T4内切核酸酶V(一种已知可催化胸苷二聚体修复的限速酶)处理紫外线照射过的黑色素细胞,能够在体外增强其晒黑反应。Gilchrest及其同事率先开发了局部应用小型DNA片段(如胸腺嘧啶二核苷酸pTpT)的技术,研究表明,这些片段能够诱导酪氨酸酶的上调并增加色素沉着。该分子机制可能与p53、p21或PCNA(增殖细胞核抗原)有关,暴露于pTpT后,这些分子在时间上与紫外线照射后的反应类似。
p38应激激活激酶被认为通过磷酸化上游转录因子USF-1参与调控紫外线引起的色素沉着。USF-1是一种基础螺旋-环-螺旋亮氨酸拉链型转录因子,能够结合酪氨酸启动子。在从Usf-1–/–小鼠中提取的黑色素细胞中,发现POMC和MC1R启动子对紫外线的激活出现缺陷。此外,体外研究显示,α-MSH也能激活p38丝裂原活化蛋白激酶。其他相关信号通路包括内皮素-1、β-成纤维细胞生长因子β-FGF、一氧化氮、p基因座和干细胞因子SCF。某些独立的生理过程,例如X射线辐射和化疗引发的DNA损伤,也能激发晒黑反应,且可能与紫外线反应的通路有所重叠。
无法晒黑的现象反映了与紫外线色素沉着反应相关的多个重要遗传特征。MC1R的变异可能导致受体功能减弱,表现为配体结合减少或腺苷酸环化酶的激活受限,这使得个体无法有效晒黑(如红发人群)。这些个体通常容易产生雀斑,但难以形成均匀的保护性色素层,并且容易晒伤,尽管这种现象的确切机制尚不清楚。Brash等人发现,紫外线引发的“晒伤细胞”(即凋亡的角质形成细胞)形成需要p53的参与,这表明p53在应对紫外线等环境因素时发挥着关键调控作用,验证了p53作为“组织守护者”的功能。
关于紫外线引发的晒黑反应的进一步理解来自K14-SCF转基因小鼠模型。通过这一模型,研究人员获得了表达表皮黑色素细胞的浅色皮肤小鼠(Mc1re/e),并发现这些小鼠对紫外线高度敏感。在小鼠和人类的角质形成细胞中,紫外线刺激可引发POMC/α-MSH表达水平增加超过30倍,提示角质形成细胞在“感知”紫外线并促使α-MSH合成和分泌中发挥了重要作用。MC1R的突变导致晒黑反应完全丧失,这一结果在预期之中。不过,研究人员通过外用佛司可林绕过Mc1r突变,直接激活腺苷酸环化酶,成功在基因上浅色皮肤的小鼠中诱导了显著的皮肤变黑。诱导的色素沉着模式展现了正常的组织学特征,例如角质形成细胞中的核“帽盖”,并在紫外线暴露后显著减少了晒伤细胞的形成、嘧啶二聚体的形成以及皮肤癌的发生。这些发现表明,在适当的刺激下,深色皮肤的色素沉着机制依然存在,后续研究将进一步验证这一现象在人类中的适用性。
紫外线响应及其与皮肤癌的风险:
皮肤色素是如何保护皮肤的?虽然人们普遍认为这与黑色素的直接屏蔽作用有关,但这一过程尚未被完全理解。可以确定的是,皮肤的色素沉着以及晒黑能力与较低的皮肤癌风险相关。通过最小红斑剂量评估黑色素的防护效果时,即使是肤色最深的人,其防护效能仅为没有黑色素的10至15倍左右(这意味着防晒系数 (SPF) 相对较低)。然而,色素在皮肤癌风险方面的防护效能却高达500到1000倍,这表明色素沉着较深的皮肤对癌变有显著的保护作用。尽管这一差异受到多种因素的影响,如量化估算和终点的不同,但它暗示色素对不同结果(如晒伤和皮肤癌)的保护机制可能有所差异。
深色皮肤的癌症防护效能显著高于浅色皮肤,这可能与金发或红发色素的相关机制有关。研究显示,MC1R基因的变异与黑色素瘤和非黑色素瘤皮肤癌的风险增加相关,这与皮肤色素(包括红发表型)的存在无关。类黑色素可能作为一种光敏剂,在紫外线照射下生成活性氧类,并且与更高的细胞凋亡率有关。因此,增加的类黑色素可能是黑色素瘤的风险因素,尽管这一过程的确切机制尚未完全明确,目前的研究正在进一步探索其在致癌中的直接作用。此外,防晒霜对癌症的防护效能仍然存在复杂的争议。
图片来源:文献
黑色素细胞的发育
Melanocyte development
黑色素母细胞的迁移路径:
黑色素细胞的发育源自其前体细胞——神经嵴细胞,展现了这一细胞独特的特性。神经嵴细胞是一类多能细胞,位于神经管顶部的表皮外胚层和神经板之间。除了能分化出黑色素细胞外,神经嵴细胞还可以分化成神经元和胶质细胞、肾上腺髓质细胞、心脏细胞以及颅面组织。作为黑色素细胞的前体,黑素母细胞在向基底表皮和毛囊迁移、增殖和分化的过程中成熟,尽管黑色素细胞在不同物种中的分布情况有所不同。
小鼠胚胎中黑色素细胞的发育已得到较为详细的研究。Jackson及其同事开发了一种方法,通过在Trp2启动子中加入lacZ转基因来可视化小鼠的黑素母细胞。在小鼠胚胎的第8.5天左右,黑素母细胞从多能神经嵴细胞分化而来,沿背外侧路径迁移,最终穿过真皮向腹侧潜入。黑色素细胞迁移的缺陷通常会在腹侧最显著地表现为“白斑”,因为该区域距离背部最远,被称为“分水岭”区域。在小鼠胚胎的第14.5天时,黑色素细胞从上层真皮中退出,分布于表皮和发育中的毛囊中。此外,黑色素细胞还会到达眼睛后部的脉络膜、虹膜、软脑膜和耳蜗的血管纹。
黑色素细胞的迁移受到多种信号通路和转录因子的严格调控。这些蛋白和通路通过提供和整合空间和时间信号,营造出适合正常发育和迁移的环境。参与该过程的基因发生突变时,会导致因黑色素细胞缺失而出现的色素减少,而不是像白化病那样由于功能性黑色素细胞缺乏色素。参与该发育路径的关键基因包括PAX3(paired-box 3)、SOX10(性别决定区Y(SRY)-box 10)、MITF、内皮素3和内皮素受体 B(EDNRB)。这些基因的缺陷有助于我们更深入地理解某些人类遗传性色素缺乏症,特别是以听力缺陷和色素异常为特征的 Waardenburg 综合征(WS)。与其高度相关的 Tietz 综合征则具有相似的表型,但由MITF基因的显性负性突变引起。由于这些基因在分子和表型上的关系已经明确,它们构成了一个交互的黑色素细胞调节因子的上位树。
REFERENCES
Lin JY, Fisher DE. Melanocyte biology and skin pigmentation. Nature. 2007;445(7130):843-50.
