小眼症转录因子:
Waardenburg综合征(WS)的典型表型主要在WS类型2患者中表现出来,其特征包括先天性白发束、虹膜颜色不对称(虹膜异色症)和感觉神经性耳聋,均源自黑色素细胞迁移的异常。部分WS类型2患者(WS2a)带有MITF基因的生殖系杂合突变。60多年前,Mitf基因首次作为小鼠毛色突变基因被发现。纯合突变的小鼠表现出小眼、白色毛发和耳聋,这反映了受影响的细胞类型,包括视网膜色素上皮(RPE)细胞(Mitf突变会导致小眼畸形)、破骨细胞(某些突变等位基因在纯合状态下引发骨质硬化)以及肥大细胞(突变引起严重功能障碍)。目前在小鼠及其他物种中发现了多种Mitf突变,为该基因位点及其在黑色素细胞发育中的关键作用提供了深刻见解。
MITF是Myc相关碱性螺旋-环-螺旋亮氨酸拉链(bHLH-Zip)转录因子家族的一员,在几乎所有脊椎动物中都高度保守。与其他bHLH-Zip因子类似,MITF能结合经典的E盒序列(CA[T/C]GTG)。MiT亚家族成员包括MITF、TFEB、TFE3和TFEC。这些MiT因子可在各种组合中形成同源或异源二聚体,虽然不同组织的特异性表达在特定情境中限制了其结合组合。在黑色素细胞中,MITF是关键成员,而在破骨细胞中,MITF和TFE3可形成异源二聚体,并展现功能上的互补性。MITF等三种MiT因子还被发现为人类癌基因,并参与多种恶性肿瘤的形成,包括黑色素瘤。
WNT/β-连环蛋白信号通路对神经嵴的诱导和黑色素细胞的发育至关重要。缺乏Wnt1和Wnt3a的小鼠表现出色素缺陷。WNT1和WNT3A触发一条经典信号通路,通过β-连环蛋白在TCF/LEF(T细胞因子/淋巴增强因子)启动子/增强子元件上进行转录调控。已识别出多个TCF/LEF靶基因,包括非黑色素细胞中的Myc和细胞周期蛋白D1,以及黑色素细胞和黑色素瘤细胞中的MITF、TRP2和SOX10。在斑马鱼中,β-连环蛋白的过度表达可以促进黑素母细胞的形成,同时减少神经元和胶质细胞的形成。
图片来源:文献
黑素细胞归巢至表皮和毛囊:
c-Kit是一种酪氨酸激酶受体,参与黑素母细胞的增殖、生存和迁移。Kit配体(KitL,或称为钢因子或SCF)激活c-Kit后,激活Ras,并触发多个经典信号通路,同时导致MITF的翻译后修饰。在常染色体显性遗传的腹侧色素缺失性疾病白斑病中,已检测到c-Kit、SCF和SNAI2(SLUG)基因突变。白斑病的特征是白发束,但与Waardenburg综合征(WS)不同,白斑病不伴随耳聋,且主要表现为皮肤白色、无黑色素细胞的色素缺失区而非毛发异常。然而,有报道指出一例携带c-Kit突变的患者伴有感觉神经性耳聋但无皮肤色素变化,提示白斑病和WS之间可能存在重叠综合征。
SCF在黑素母细胞的存活和增殖中起着至关重要的作用,包括在早期的背外侧迁移路径中,以及从真皮间充质向毛囊和表皮的迁移。在角蛋白启动子(K14)控制下表达Scf转基因,可支持毛皮动物如小鼠表皮中的黑色素细胞定植,否则这些动物在被毛覆盖区域中几乎没有表皮黑色素细胞。BCR-ABL酪氨酸激酶抑制剂甲磺酸伊马替尼(STI571或Gleevec)也可抑制c-Kit酪氨酸激酶活性,可能引起皮肤色素(黑色素细胞)的丧失。
SLUG是一种与白斑病相关的锌指转录因子。在小鼠中,Slug基因突变可导致与白斑病相似的表型,包括贫血、不孕、白发束以及腹侧躯干、尾巴和足部的色素丧失。在没有c-Kit突变的白斑病患者中,发现了SLUG编码区的杂合性缺失。此外,WS2中也检测到SLUG突变,研究表明MITF可与SLUG启动子结合。SLUG似乎对黑素母细胞的迁移和/或存活至关重要。在黑色素瘤小鼠模型中,通过小干扰RNA(siRNA)抑制SLUG可以降低其转移能力,提示SLUG可能与迁移和转移相关行为有关。
除了c-Kit/SCF以外,其他机制也可能参与黑色素细胞在真皮向表皮迁移的后期过程,其中包括内皮素1和3、肝细胞生长因子(HGF)和碱性成纤维细胞生长因子(FGF)。Merlino等人发现,当HGF在金属硫蛋白启动子的驱动下表达时,小鼠体内多处部位会发生黑色素沉着,显示出HGF对黑色素细胞定位的影响。该模型因在新生期单次紫外辐射(UVR)后黑色素瘤发生率高而备受关注。钙黏着蛋白也在此过程中起作用:当真皮黑素母细胞穿过基底膜时会表达E-钙黏着蛋白,但迁移至毛囊时转而表达P-钙黏着蛋白。Barsh等人通过筛选小鼠显性表型发现了两类暗皮肤(Dsk)突变。第一类包括G蛋白(Gna11和Gnaq)的激活突变,导致真皮中过量黑素母细胞产生,尽管表皮和毛囊中的数量正常。Dsk突变可以补偿PAX3和c-Kit的缺陷,但在Ednrb–/–小鼠中则不起作用,表明Gq突变通过细胞自发放大正常的内皮素信号,导致早期黑素母细胞的过量产生。
黑素母细胞的存活:
MITF在多能神经嵴细胞向黑素母细胞转变的早期被激活,是黑素母细胞存活的关键。MITF的完全缺失会导致黑色素细胞的缺乏,表明MITF对于该细胞谱系的存活和增殖,或防止其向其他神经嵴细胞类型(如神经胶质细胞和神经元)转分化是必不可少的。来自Mitfvit基因的弱表达突变的研究表明,MITF对于黑色素细胞的终生存活都至关重要。Mitfvit突变表现为黑色素细胞的近乎正常发育,但由于出生后黑色素细胞逐渐丧失而导致毛发提前变灰。
MITF的转录靶点Bcl-2(B-细胞白血病/淋巴瘤2)是一种已知的凋亡抑制因子,也对黑色素细胞的存活至关重要。另一个MITF靶点是细胞周期调节因子Cdk2,其在黑色素瘤细胞中对于细胞周期和存活必不可少。然而,MITF与Bcl-2和Cdk2的相互作用并不能完全解释发育期间黑色素细胞对MITF的依赖性,因为Mitf-null纯合突变体的表型比单一基因敲除的情况更严重,且在Mitf-敲低的黑色素瘤细胞中表达这两个基因只能部分恢复细胞活力。
细胞因子受体c-Met最近被发现是MITF的另一个直接转录靶点。MITF还鉴定出了许多其他靶标,包括CDK抑制剂p16INK4a和p21/Cip1。这些靶标可能共同促进MITF在黑色素细胞分化和存活/增殖方面的双重作用,其中一些可能作为MITF肿瘤基因通路的替代药物靶点。MITF媒介的存活功能应与分化标记相区别,因为MITF被认为协调调节色素基因的表达,尽管可能依赖于其他上下文相关因素。除了酪氨酸酶、TRP1和TRP2,MITF在黑色素细胞中的色素靶点还包括银蛋白(PMEL17,亦称gp100,编码黑色素瘤诊断表位HMB45)、melan-A(又名MART1)、melastatin(TRPM1)和AIM1(眼皮肤性白化病4)。
图片来源:文献
黑色素细胞干细胞与灰发:
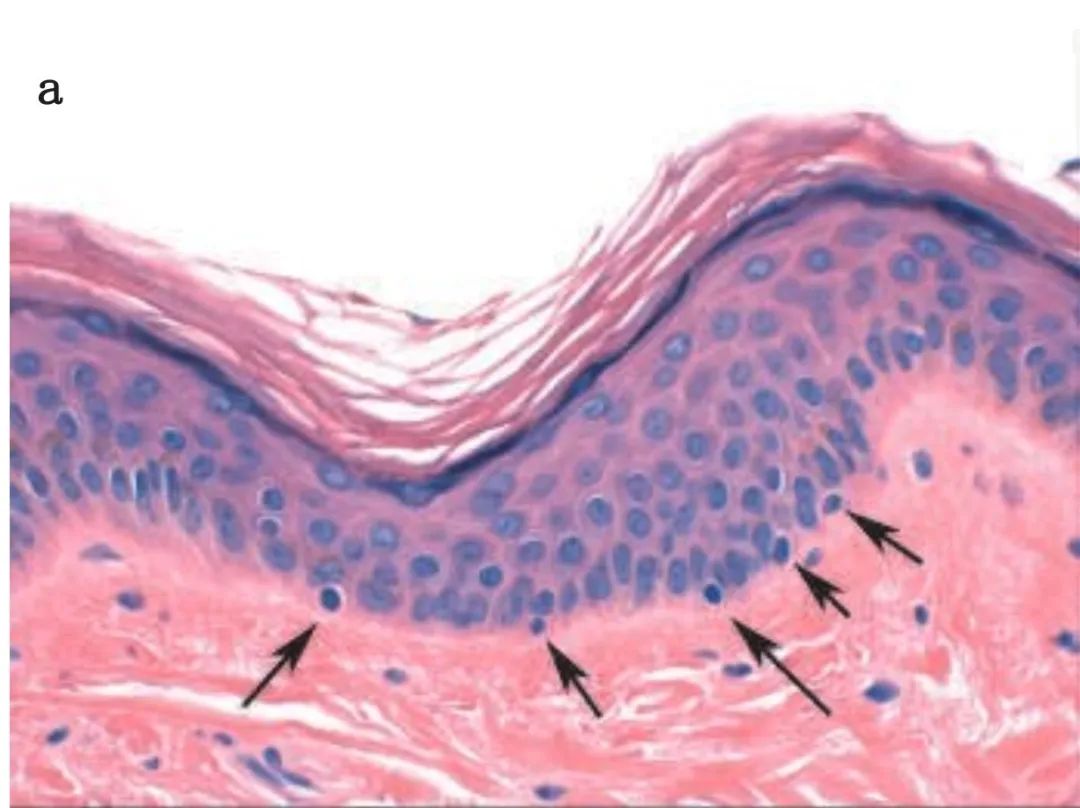
毛囊中的黑色素细胞负责头发的色素。毛囊黑色素细胞的生命周期与整个毛囊的生命周期密切相关,通常处于生长期(anagen),随后经历短暂的退化期(catagen),最后进入休眠期(telogen),在此期间毛发脱落,周期可以重新开始。毛囊的隆起区域(位于毛囊的永久部分底部,刚好在皮脂腺下方)中存在多能表皮干细胞。黑色素细胞干细胞也位于此,负责将分化的黑色素细胞恢复到毛囊球中,在新毛发合成时将色素融入其中。满足“干性”特征的关键包括缓慢的细胞循环、自我维持、未成熟性和在适当刺激下再生后代的能力。白癜风患者(表皮缺失黑色素细胞)提供了独立验证,表明黑色素细胞干细胞的生态位存在于毛囊中。这些患者因免疫抑制治疗而导致白癜风,且再色素化显然是从毛囊以放射状方式启动的。
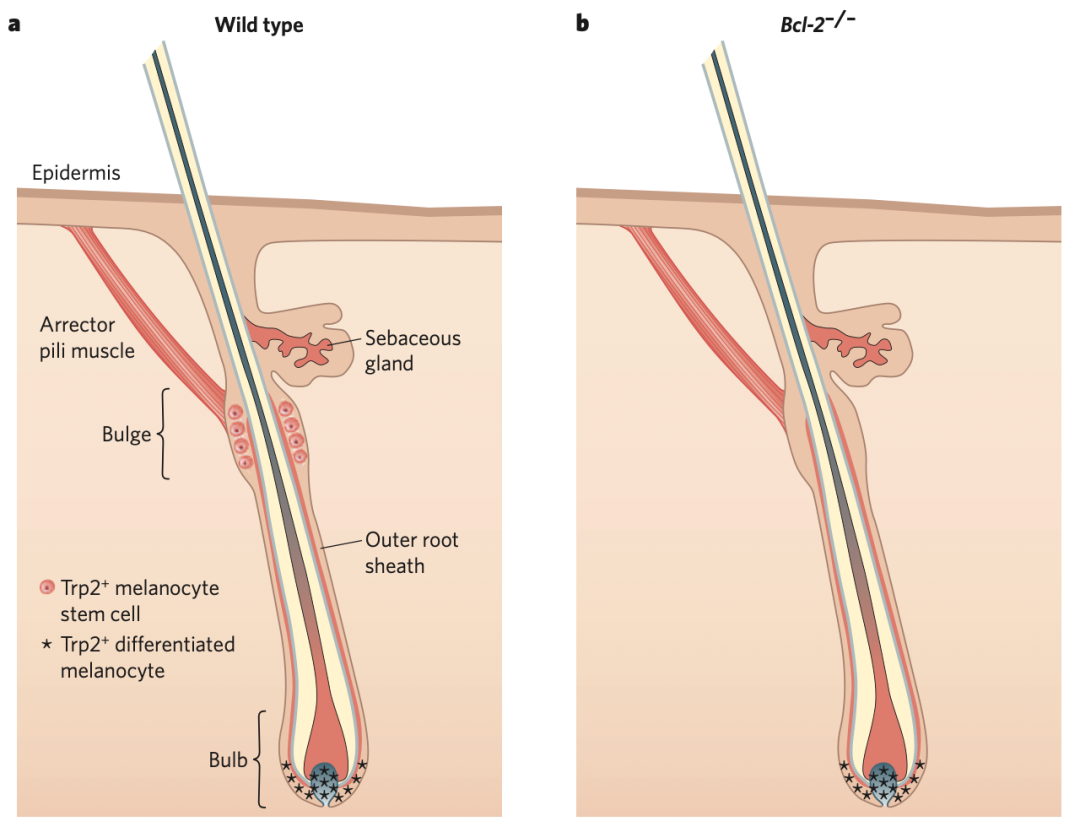
Dct-lacZ转基因小鼠帮助研究人员识别隆起区域中的黑素母细胞群体。通过对多个小鼠毛发变灰模型的分析,展示了这一系统的强大。Bcl-2–/–小鼠出生时有正常色素,但在第二个毛囊周期时变灰。出生时,Bcl-2–/–小鼠表现出正常的黑色素细胞形态和分化,尽管有研究建议认为某些毛囊中黑色素细胞干细胞的形成可能存在缺陷。在出生后第6到8天,所有隆起黑色素细胞会突然丧失,而毛囊球黑色素细胞会持续到第一个毛囊周期结束。这一显著表型表明,在毛囊周期生长期,维持黑色素细胞干细胞对Bcl-2的选择性需求。
在缺乏突变小鼠Mitfvit中,观察到了更为渐进的头发变灰现象。在这种情况下,隆起区域的黑色素细胞逐渐减少,但仍然明显快于野生型。在干细胞群体丧失之前,隆起区域出现了意外的产色细胞。由于分化和色素生成通常与干细胞状态不兼容,因此这种“异常”的隆起色素可能表明黑色素细胞干细胞库的异常退出。最终以这种方式耗尽干细胞将导致后续毛囊周期中出现灰色或白色毛发。
小鼠和人类毛囊的年龄相关变灰也伴随着隆起黑色素细胞的减少,并且在这些(生态位)黑色素细胞中也先出现了“异常色素”。然而,是否存在其他人类变灰的原因尚待观察,比如在使用伊马替尼的患者中报告的意外变暗情况,这显然不涉及黑色素细胞干细胞的耗尽。这些情况可能更容易应用“救助”策略来解决灰色问题。
未来展望
Future prospects
黑色素细胞生物学仍处于实验室和临床的交汇点。虽然许多色素突变体在表型上具有深刻的意义,但其机制仍未得到明确阐述。色素突变体不仅在基础遗传和发育机制方面提供了重要信息,还为光保护、癌症易感性以及人类进化过程提供了线索。随着靶向基因缺失技术的进步,揭示色素生成的遗传调控因子将变得更加显著,避免了对重要基因的胚胎致死影响。
黑色素细胞的某些特定谱系特征引起了应有的关注,留下了许多待解的重要问题。黑色素细胞对毛囊生存的非必要性为识别和发现与黑色素细胞谱系相关的重要基因提供了机会。黑色素细胞干细胞与其分化后代的物理分离也为实验提供了独特的优势。尚需回答的关键问题包括:是什么信号调节黑色素细胞干细胞的觉醒与静止状态的回归?确定调节干细胞减少和隆起黑色素细胞“异常色素”的信号非常重要,这些信号在干细胞丧失和毛发变灰之前就会出现。黑色素细胞干细胞在多大程度上依赖于专门的生态位,可能在多大程度上用于其他用途,如伤疤再色素化或人工皮肤?在退化期,调节黑色素细胞死亡的信号是什么?这些问题也可能为表皮黑色素细胞生物学提供线索,表皮黑色素细胞之间的细胞间通信同样至关重要,但目前对此的理解仍然有限。
黑素细胞的生长或存活失调是一种极为常见的现象。几乎所有人都拥有多个痣,这些痣是良性、衰老的肿瘤,极少(如果有的话)会转变为侵袭性黑素瘤。BRAFV600E转化的黑素细胞是否是这种克隆转化最常见的例子?还是类似的良性新生物在其他组织中也普遍存在,但因缺乏色素而不明显?为什么黑素细胞新生物如此少见UVR特征性突变,特别是当黑素瘤的发生率与皮肤光型和UVR曝露的结合相关时?是否可能角质形成细胞是主要的UV反应细胞,而黑素瘤的形成在很大程度上是由于慢性反应性刺激/增殖的结果(类似于其他与慢性炎症相关的癌症)。
皮肤是人类最常见的癌症部位,但其恶性肿瘤可能是最可预防的癌症之一。相当一部分恶性肿瘤是由已知的环境致癌物UVR引起的。在当今社会,许多人从事特定的寻阳活动,而其他情况下的阳光暴露则是偶然和非故意的。在使用防晒霜时,可能也会与对其保护类型的误解相关。我们可能会越来越多地发现机会,以改善对黑素细胞在癌症发展中的贡献的理解。利用黑色素及其光保护作用的能力,可能会降低易感人群的癌症风险。随着越来越多改进的动物模型、高质量的人类诊断试剂、后基因组时代丰富的数据资源以及针对性治疗日益增加的机会,安全调节黑素细胞及其活动的新方法有望出现,这些活动的目的包括化妆品开发和癌症预防。
REFERENCES
Lin JY, Fisher DE. Melanocyte biology and skin pigmentation. Nature. 2007;445(7130):843-50.
